SINDROME DI BRUGADA, SPESSO LA DIAGNOSI E’ TARDIVA
Sindrome di Brugada: un nome famoso, sentito sicuramente più volte nominare ma di cui non tutti conoscono il significato clinico. Di cosa parliamo? La sindrome di Brugada è una condizione clinica potenzialmente letale legata ad una malattia genetica che espone chi ne è affetto ad aritmie ventricolari maligne e che può causare morte improvvisa in giovani adulti con cuore strutturalmente sano.
Epidemiologia.
A livello epidemiologico gli uomini manifestano la malattia più frequentemente delle donne (difficilmente questa sindrome si manifesta in età pediatrica) ed ha una prevalenza stimata di 5 su 10.000 con una trasmissione autosomica dominante: ciò significa che la probabilità di trasmettere la patologia è del 50% ad ogni gravidanza.
Brugada nell’ECG.
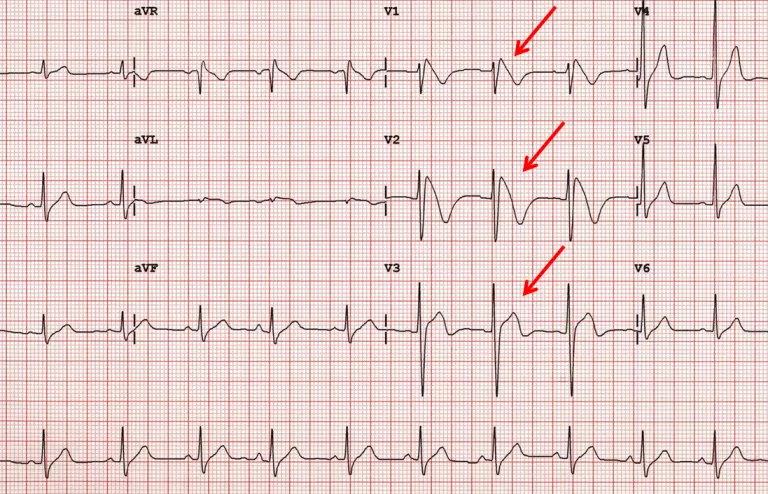
Il principale gene alla base di questa malattia è SCN5A, che codifica per il canale del sodio all’interno delle cellule cardiache: all’ecg è caratterizzata da un sopraslivellamento del tratto ST nelle derivazioni precordiali di destra (V1-V2-V3, al quarto spazio intercostale a destra e sinistra dello sterno), le derivazioni che registrano l’attività elettrica del tratto di efflusso del ventricolo destro. Tuttavia la manifestazione elettrocardiografica nei soggetti affetti non è costante, caratteristica che rende problematica la diagnosi di questa condizione.
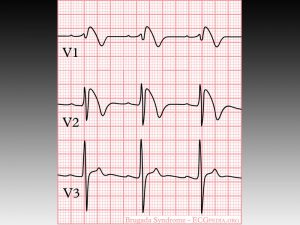
In presenza di tracciato anche solo sospetto, è bene quindi eseguire una valutazione con ecg dinamico con holter al fine di valutare l’andamento dell’elettrocardiogramma nelle 24 ore. Fondamentale è saper riconoscere il sopraslivellamento del tratto ST, detto “a tenda”, in quanto tende a discendere in linea retta fino a oltrepassare la linea isoelettrica e continuarsi con una onda T negativa. Il pattern a tenda è definito di tipo 1; esistono inoltre pattern tipo 2 con un sopra ST a concavità superiore di entità superiore a 1 mm e di tipo 3 con sopraslivellamento inferiore a 1 mm (cosiddetto aspetto “a sella”).
E’ bene inoltre sapere che un singolo paziente può presentare in diversi momenti diversi aspetti ECG grafici di Brugada, di cui il tipo I è ritenuto diagnostico.
Una volta asserito che l’aspetto elettrocardiografico configura il fenomeno di Brugada, per poter definire la sindrome però è necessario avere anche il sintomo insorgente che può andare dalla fibrillazione ventricolare documentata, tachicardia ventricolare polimorfa, storia familiare di morte improvvisa in età < 45 anni, ECG con onda j e sopraslivellamento convesso di ST in membri della famiglia alla sincope e respiro agonico notturno. Importante è fare anche diagnosi differenziale: dunque prima di porre diagnosi di Brugada è necessario escludere altre cause che possono provocare un aspetto ECG grafico simile. Parliamo di miocarditi, displasia aritmogena del ventricolo destro, l’assunzione cronica di alcuni farmaci o semplicemente la pratica sportiva intensa.
Da cosa derivano queste alterazioni?
La particolare alterazione elettrocardiografica nella sindrome di Brugada è secondaria a uno squilibrio tra le correnti ioniche entranti e uscenti dalle cellule cardiache, dovuta in genere a una ridotta funzione dei canali che conducono la corrente entrante del sodio.
La presenza di una corrente uscente di potassio (Ito), che è particolarmente rappresentata a livello del tratto di efflusso del ventricolo destro e che non è controbilanciata da quella del sodio, rende evidente l’aspetto ECG in questa particolare sede. Se ne deduce che il rischio aritmico deriva da una marcata eterogeneità nella polarizzazione di aree miocardiche adiacenti/vicine, vista la non uniforme distribuzione dello squilibrio tra le correnti ripolarizzanti e depolarizzanti. Questo favorisce fenomeni di rientro che determinano aritmie ventricolari polimorfe, che a loro volta possono degenerare in fibrillazione ventricolare e arresto cardiaco.
La diagnosi di sindrome di Brugada richiede esclusivamente la documentazione del pattern tipo I. Gli altri pattern ECG sono solo suggestivi e richiedono ulteriori indagini.
Una caratteristica molto importante del paziente con sindrome di Brugada è la variabilità nel tempo del pattern ECG, nel contesto dello stesso paziente. Ovvero, un paziente può presentare in un determinato momento della sua vita, o in determinate condizioni (ad esempio dopo i pasti, di notte o in corso di febbre, etc.) un pattern tipo I e qualche minuto dopo, invece, un pattern tipo II o tipo III. Questa variabilità rappresenta un grosso ostacolo alla diagnosi perché il riscontro di un pattern tipo I permette di fare diagnosi mentre il non riscontro di un pattern tipo I non permette di escluderla. Per superare questo limite, abbiamo 3 soluzioni, che generalmente vanno integrate:
1 ) Posizionamento delle derivazioni V1-V2 al 2°-3° spazio intercostale (figura 3): le derivazioni ECG V1-V2, normalmente localizzate in sede parasternale destra e sinistra al 4° spazio intercostale, possono invece essere posizionate anche al 2° o 3° spazio intercostale (sempre in regione parasternale destra e sinistra). Questa semplice tecnica permette di aumentare la corretta identificazione dei pazienti con sindrome di Brugada del 20-30%.
Figura 2. Variabilità dell’aspetto ECG a seconda del posizionamento delle derivazioni ECG in V1-V2 al 2°, 3° o 4° spazio intercostale. (da: Meregalli PG et al. Pathophysiological mechanisms of Brugada syndrome: depolarization disorder, repolarization disorder, or more?. Cardiovascular Research 2005;67:367– 378).
2) Test farmacologico provocativo: in pazienti con il solo sospetto pattern tipo II o III o familiarità per sindrome d Brugada ed ECG basale non diagnostico, o, ancora, nei pazienti con sintomi suggestivi per sindrome di Brugada, l’esecuzione di un test farmacologico, mediante la somministrazione in 5-10 minuti di flecainide (2 mg/Kg) o ajmalina (1 mg/Kg), rappresenta il “gold standard” per raggiungere la diagnosi e svelare la malattia sottostante. Si tratta di un esame provocativo, che quindi per sua stessa natura può esporre il paziente ad un minimo rischio di aritmie ventricolari (da 0.34% a 2.4%), anche pericolose. Per tale motivo, tale esame va sempre eseguito in ambiente ospedaliero, sotto attento monitoraggio ECG e con pronta disponibilità di un defibrillatore.
3) Holter ECG 12-derivazioni: essendo il pattern Brugada variabile e fluttuante, maggiore è il numero di ECG che una persona esegue, maggiore sarà la probabilità di identificare un pattern tipo I. L’utilizzo quindi di Holter ECG a 12-derivazioni ha un grande valore in questo senso e permette di identificare un pattern tipo I intermittente nel 20-34% dei pazienti con solo pattern tipo I indotto.


Figura 4. Slatentizzazione del pattern tipo I durante test all’ajmalina in due pazienti (Ospedale Mauriziano, Torino, 2019).
In accordo con il “consensus statement” del 2013 la diagnosi di Brugada richiede la sola documentazione ECG di un pattern tipo I, in almeno una derivazione ECG, sia al 4° che al 3° o 2° spazio intercostale, indipendentemente se spontaneo o indotto dopo test farmacologico provocativo.
Stratificazione del rischio aritmico
La precisa identificazione dei pazienti ad elevato rischio di morte cardiaca improvvisa è lo step più importante, e al contempo anche quello più difficile, nella gestione dei pazienti con sindrome di Brugada. Gli elementi che hanno ampiamente dimostrato di associarsi ad un aumentato rischio di eventi avversi sono:
- Morte cardiaca abortita: i pazienti in cui la prima manifestazione clinica è stata un arresto cardiaco rianimato (quindi una morte cardiaca abortita) hanno un rischio di eventi avversi potenzialmente fatali di circa 20 volte più alto rispetto a tutti gli altri pazienti con sindrome di Brugada e hanno un rischio annuo di nuovi eventi aritmici dell’11.1%.
- Sincope: di fronte ad un paziente con sindrome di Brugada e sincopi, è essenziale cercare di ottenere una precisa descrizione degli episodi sincopali. Le sincopi, infatti, possono essere grossolanamente ricondotte a due tipi principali: cardiache o neuromediate. Le prime sono quelle pericolose, caratterizzate da un esordio del sintomo brusco, improvviso, senza prodromi e senza chiari fattori innescanti, che possono occorrere anche da seduti o addirittura da sdraiati. Le seconde, invece, estremamente più comuni, sono assolutamente benigne e sono legate a un transitorio “malfunzionamento” del sistema nervoso autonomo deputato alla regolazione della pressione arteriosa e della frequenza cardiaca con conseguenti episodi transitori di ipotensione e bradicardia (centralmente mediati), che culminano con la perdita dello stato di coscienza. Si manifestano tipicamente con prodromi, quali senso di malessere, offuscamente della vista, giramento di testa e successiva perdita di coscienza. Occorrono quasi sempre in piedi, dopo i pasti, o con un preciso trigger scatenante. Nella sindrome di Brugada, le sincopi neuromediate non determinano nessun aumentato rischio di eventi avversi mentre, invece, lo causano le sincopi cardiogene. Queste ultime determinano un rischio annuo di aritmie ventricolari del 5.5%.
- Familiarità per morte cardiaca improvvisa: l’impatto prognostico di questo fattore è ancora abbastanza controverso. Alcuni studi ne hanno evidenziato la pericolosità in termini di aumentato rischio di eventi aritmici avversi, mentre altri non hanno dimostrato questa correlazione. È molto importante, quando si valuta la familiarità per morte improvvisa, definire quest’ultima con criteri rigorosi. Infatti, ha sicuramente un impatto prognostico ben diverso la presenza di familiarità per morte improvvisa in parenti di primo grado con età ≤ 35 anni rispetto all’avere in famiglia parenti, magari anche di secondo o terzo grado, deceduti improvvisamente ma ad una età (molto) più avanzata. Nel secondo caso, infatti, nella sindrome di Brugada non vi è alcuna correlazione con gli eventi avversi, mentre nel primo caso, il rischio di eventi aritmici pericolosi è più alto di circa 2.9 volte con un rischio annuo di nuovi eventi aritmici del 3.1%.
- Pattern tipo I spontaneo: come abbiamo visto in precedenza il pattern tipo I, ovvero quello diagnostico, può essere presente spontaneamente oppure solo dopo test provocativo con ajmalina (in questo caso di parla di pattern tipo I indotto). Il primo caso, generalmente sottintende la presenza di una mutazione più grave cha ha alterato in maniera più severa la proteina sintetizzata e, di conseguenza, le manifestazioni cliniche attese sono più negative. Il rischio di eventi avversi in pazienti con pattern tipo I spontaneo è più alto di 2.3-4.7 volte rispetto a quelli con pattern tipo I “solo” indotto, con un rischio annuo di eventi aritmici di circa 1-2.3%, contro lo 0.5% nei pazienti con solo pattern tipi I indotto. Al riguardo, è però importante sottolineare come il rischio di morte cardiaca improvvisa in pazienti con 40 anni di età e senza sindrome di Brugada sia di circa 1:10.000 all’anno, quindi circa 50 volte inferiore rispetto a quello dei pazienti con sindrome di Brugada e documentazione di un pattern tipo I “solo” indotto.
- Malattia del nodo senoatriale: la malattia del nodo senotriale può essere associata alle mutazioni del canale del sodio. Non deve quindi stupire che si può presentare nei pazienti con sindrome di Brugada. Si associa, generalmente, a una malattia più severa e precoce, in cui i pazienti sono frequentemente sintomatici. I pazienti con sindrome di Brugada e malattia del nodo senoatriale hanno un rischio 5 volte più alto di eventi avversi con un rischio annuo di aritmie ventricolari del 4.3%.
- Studio elettrofisiologico: lo studio elettrofisiologico, o SEF, consiste nel posizionamento per via percutanea attraverso la puntura della vena femorale, di un catetere in ventricolo destro e nella stimolazione del cuore con un protocollo di stimolazione rigoroso e ampiamente codificato, al fine di valutarne la vulnerabilità elettrica, ovvero l’inducibilità o meno di aritmie ventricolari sostenute (tipicamente tachicardie ventricolari polimorfe o fibrillazione ventricolare). Importante sottolineare come, in pazienti “sani”, senza aritmie ventricolari documentate e senza cardiopatia strutturale, l’inducibilità di una di queste due aritmie al SEF con protocolli di stimolazione ventricolare programmata e due extrastimoli (senza chiaramente l’utilizzo di rampe o burst pacing ad elevatissime frequenze) rappresenta un evento estremamente raro e poco probabile (<1%). Nonostante molti anni e numerose ricerche, il ruolo del SEF nella stratificazione del rischio nei pazienti con sindrome di Brugada è ancora oggi oggetto controverso, supportato da molti, rifiutato da altri. Globalmente i dati dimostrano che nei pazienti con sindrome di Brugada e SEF positivo (ovvero con induzione di FV) il rischio di eventi avversi è più alto di 4.7-8.3 volte con un rischio annuo di aritmie ventricolari del 3.3%.
- Altro: vi sono poi ulteriori elementi, quali la storia di fibrillazione atriale, la presenza di un QRS frammentato, un QRS allargato, il QTc allungato, un BAV di I grado, la presenza dei potenziali tardivi, la presenza di un pattern ECG da ripolarizzazione precoce nelle derivazioni infero-laterali, le alterazioni della ripolarizzazione e la presenza di una onda S in DI, il cui ruolo prognostico deve ancora essere confermato in maniera definitiva.