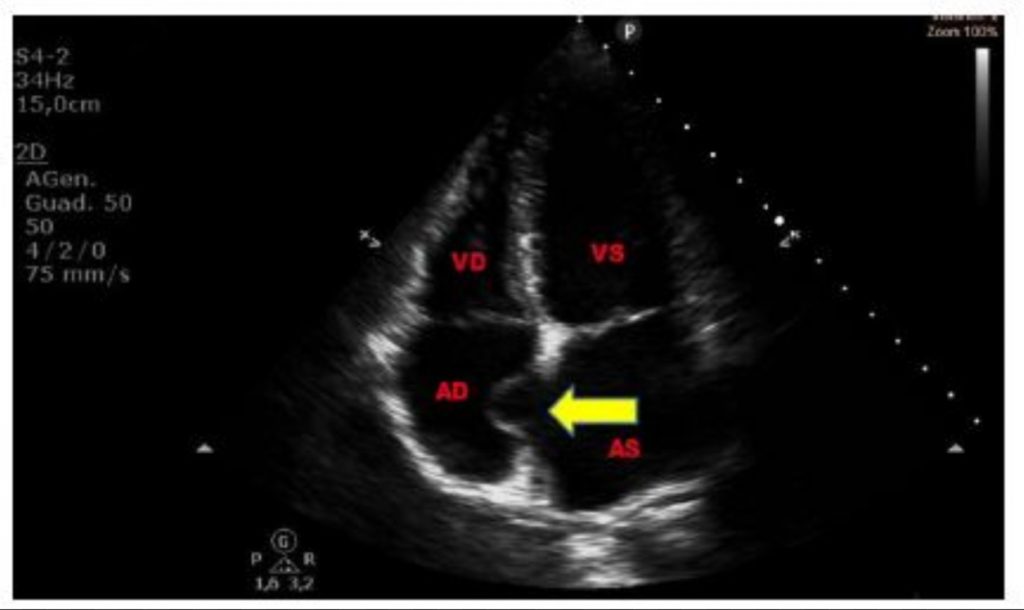
 L’Aneurisma del setto interatriale (ASA) è una anomalia cardiaca conosciuta, ma di dubbio significato clinico, diagnosticata con l’ecocardiografia, associata spesso a stroke.
L’Aneurisma del setto interatriale (ASA) è una anomalia cardiaca conosciuta, ma di dubbio significato clinico, diagnosticata con l’ecocardiografia, associata spesso a stroke.
Nonostante gli outcome della letteratura sull’argomento, non è stato possibile definire il meccanismo patogenetico con cui l ‘ASA è associato ad altre anomalie congenite, potenzialmente emboligene. Ciò rende molto difficile chiarire il suo ruolo, come malformazione isolata, nel determinismo dell’ischemia cerebrale.
In questa review, si è cercato di: identificare il ruolo dell’ ASA nell’ischemia cerebrale chiarendo il meccanismo d’azione patogenetico; sintetizzando le classificazioni e i termini delle definizioni per la diagnosi ecocardiografica di questa patologia
Tra le patologie cardiache che possono causare accidenti cerebro-vascolari intendiamo come cardio-emboliche quelle patologie cardiache in grado di generare emboli che viaggiando nel circolo ematico possono ostruire parzialmente o completamente vasi cerebrali causando così l’ictus o stroke.
Secondo la classificazione TOAST il 15-20% degli ictus, fisiopatologicamente sono di origine cardioembolica.

Obiettivo della presente revisione è quello di valutare l’aneurisma del setto quale causa di reale embolismo.
Embriologia del setto interatriale:
Nella vita fetale durante la proliferazione dei cuscinetti endocardici, a livello del canale atrio-ventricolare, dalla parete dorso craniale dell’atrio comune inizia la formazione di un setto membranoso detto septum primum. Questo cresce nella primitiva cavità atriale in direzione dei cuscinetti endocardici e separa gradualmente l’atrio comune in un atrio destro ed uno sinistro. Prima che il septum primum raggiunga il setto intermedio, derivato dai cuscinetti endocardici, i due atri risultano comunicanti attraverso un piccolo ostium primum. Con la crescita del setto, questo forame gradualmente si riduce e, quando il margine del septum primum raggiunge il setto intermedio, si oblitera. Intanto per un processo di morte cellulare programmata nella parte dorso-craniale del septum primum compaiono piccole aperture che confluiscono in un nuovo canale di comunicazione tra i due atri, l’ostium secundum.
Una seconda proliferazione a struttura muscolare si forma dalla parete ventro-craniale dell’atrio, alla destra del septum primum, e viene detta septum secundum. Esso cresce parallelamente al septum primum senza però raggiungere il setto intermedio.
L’apertura che persiste tra il bordo libero del septum secundum e l’ostium secundum è nota come forame ovale.
La porzione superiore del septum primum si fonde col septum secundum mentre la rimanente porzione diventa un struttura di tipo valvolare per il forame ovale. Quest’ultimo è posto all’estremità posteriore del setto in direzione dello sbocco della vena cava caudale.
Nel corso della vita fetale i due atri sono quindi separati da due setti paralleli e tuttavia comunicano attraverso i rispettivi fori: l’ostium secundum del septum primum ed il foro ovale del septum secundum.
L’Aneurisma del Setto Atriale (ASA) è un assottigliamento della parete del Setto Inter Atriale (SIA), a volte associata a Permanenza del Forame Ovale (PFO), a volte no, che tende a muoversi leggermente da una parte all’altra degli atri durante la sistole del cuore (come una piccola vela che sbandiera). Negli ultimi 30 anni, grazie all’ecocardiografia e la sua rapida evoluzione, l’aneurisma del setto non è più un reperto autoptico , ma una ben nota anomalia cardiaca. Più spesso l’ASA coinvolge la regione della fossetta ovale o l’intero setto e talvolta l’aspetto visibile all’ecografia è determinato dalla differenza di pressione tra i due atri (CMD, disfunzione atriale sinistra,etc…)
Morfologicamente, l’ASA è descritto come una parete assottigliata costituita da tessuto connettivo delimitato su entrambe le superfici da cellule endoteliali. Gli studi autoptici hanno dimostrato che, istologicamente, un setto aneurismatico è più sottile (0.4-0.8 mm) di un setto normale (2 mm), le cellule muscolari sono assenti o appaiono vacuolate (degenerate) ed, infine, sono presenti più cellule grasse e meno fibre collagene.
Agli esordi della diagnostica clinica-ecocardiografica, sull’ identificazione dell’ASA spesso era difficile distinguere tra un setto lievemente ridondante ed un vero aneurisma e per tale motivo è stato stabilito un cut-off numerico, veniva definito aneurisma del setto una protrusione > 10 mm del setto interatriale oltre il piano del setto, o verso uno dei due atri destro o verso l’atrio sinistro.
Successivamente a metà degli anni 80, Hanley et al.9 formularono la prima e sistematica definizione dei criteri diagnostici, che sono i seguenti:
– protrusione o “bulging” del setto interatriale o di una parte di esso > 15 mm, oltre la linea mediana che identifica il piano del setto;
– escursione fasica del setto interatriale, durante il ciclo respiratorio, con una somma globale dell’escursione > 15 mm;
– base della porzione aneurismatica > 15 mm (Fig. 1).
In seguito tali criteri, sono stati, in parte, modificati ad opera di altri autori che hanno considerato sufficiente per la diagnosi di ASA un’escursione del setto > 10 mm all’interno dell’atrio destro o sinistro, oppure, una somma totale delle escursioni bidirezionali > 10 mm con una base ≥ 15 mm.
Con questa nuova definizione il numero di aneurismi evidenziati con l’ecocardio aumentano numericamente, rientrando nei termini della definizione. Purtroppo come spesso accade più classificazione hanno generato confusione e contemporaneamente sotto o sovrastimato le diagnosi effettivamente corrispondenti alla realtà.
I criteri diagnostici, grazie ad esame ecografico, sono i seguenti:
- protrusione o “bulging” del setto interatriale o di una parte di esso > 15 mm, oltre la linea mediana che identifica il piano del setto;
- escursione fasica del setto interatriale, durante il ciclo respiratorio, con una somma globale dell’escursione > 15 mm;
- base della porzione aneurismatica > 15 mm.
In seguito tali criteri, sono stati, in parte, modificati ad opera di altri autori che hanno considerato sufficiente per la diagnosi di ASA un’escursione del setto > 10 mm all’interno dell’atrio destro o sinistro, oppure, una somma totale delle escursioni bidirezionali > 10 mm con una base ≥ 15 mm.

Figura 1. Disegno schematico per la definizione di aneurisma del setto interatriale: protrusione del setto interatriale (a) o escursione fasica dello stesso,
durante il ciclo cardiorespiratorio, > 15 mm di ampiezza totale (b) e diametro della base della porzione aneurismatica del setto interatriale > 15
mm (c). LA = atrio sinistro; RA = atrio destro. Da Agmon et al., modificata.
A tali classificazioni si sono rifatti i più importanti studi presenti in letteratura sull’ASA. Il criterio di scelta dell’una piuttosto che dell’altra è stato del tutto soggettivo e variabile da autore ad autore.
Prevalenza dell’aneurisma del setto interatriale
La prevalenza dell’ASA si modifica, principalmente, al variare delle seguenti tre condizioni:
1) La tecnica diagnostica utilizzata: con i criteri appena descritti, studiato con l’ETT, l’ASA si riscontra nello 0.08-1.2% della popolazione sana; ma, con l’ETE tale percentuale sale al 2-10% della stessa popolazione. È importante ricordare che i dati di prevalenza ricavati dall’ETT si riferiscono al periodo precedente l’utilizzo dell’ETE;
2) La popolazione oggetto di studio: nella popolazione generale la prevalenza è controversa a causa di una mancanza di uniformità dei criteri di selezione utilizzati. Recentemente, da un’analisi di alcuni dei più importanti lavori apparsi in letteratura dal ’93 al 2000, si è osservata con ETE, una prevalenza cumulativa di ASA, in popolazioni non selezionate, del 6% che sale al 16.5%
se si considerano gli esami eseguiti per la ricerca di fonti cardioemboliche, in pazienti con recente episodio ischemico cerebrale. Secondo la metanalisi di Overell et al., la prevalenza di ASA è del 2-17% nello stroke in generale, del 4-25% nello stroke criptogenetico, dello 0.2-22% nello stroke da causa nota, dello 0-15% nella popolazione di controllo;
3) I criteri diagnostici utilizzati: in letteratura esiste una notevole disomogeneità dei criteri diagnostici usati che interessa sia la definizione di setto “aneurismatico” (ampiezza dell’escursione, larghezza della base di impianto, ecc.), ma anche la classificazione dei sottotipi di ASA, in base alla morfologia rilevata all’ecocardiografia (mobilità, prevalenza dell’escursione verso l’una o l’altra camera atriale, ecc.); in altre parole, nei numerosi studi sull’argo- mento sono state arbitrariamente utilizzate ed accettate, come criteri diagnostici e descrittivi, definizioni di aneurisma non univoche, anche se i criteri di Hanley et al. sono quelli che appaiono con maggiore frequenza.
Una simile difformità, evidentemente, ha in parte inficiato l’attendibilità degli studi di prevalenza di tale anomalia.
Il legame tra ischemia cerebrale e ASA è stato, per la prima volta, suggerito nel ’97 da Belkin con uno studio retrospettivo e, successivamente confermato da vari studi multicentrici.
Tuttavia questi studi non sono stati adeguatamente confrontati con gruppi di controllo.
Nel ’99 grazie al lavoro Pearson viene pubblicato il primo studio caso-controllo che ha dimostrato, nei pazienti con pregresso stroke, una prevalenza di ASA maggiore rispetto a quella evidenziata nella popolazione sana.
Sempre nel ’99 con studio SPARC (Stroke Prevention: Assessment of Risk in a Community) viene ribadita una maggiore prevalenza dell’ASA nei pazienti con stroke ischemico rispetto al gruppo-controllo costituito da popolazione sana dimostrando che nel 6% dei pazienti non vi era alcuna sorgente alternativa per embolismo cerebrale.
La stessa percentuale dell’86% viene confermata da da Mattioli nel 2001.
In tabella I sono riportati i risultati fino al 2004 dei principali studi condotti sulla prevalenza dell’ASA nell’ischemia cerebrale, in pazienti con documentata assenza di patologia carotidea e/o fonti cardioemboliche aggiuntive.
Sono inoltre compresi studi di confronto, tra la prevalenza dell’ASA nei pazienti affetti da stroke criptogenetico ed in quelli senza eventi ischemici cerebrali e studi di prevalenza assoluta di tale anomalia, nei pazienti con stroke criptogenetico, la prevalenza dell’associazione tra ASA e PFO (che in alcuni studi risulta particolarmente elevata in relazione alla metodologia utilizzata).
Una metanalisi eseguita su ampia scala, di Overell JR pubblicata su Neurology nel 2200 ha confermato, che sia l’ASA che il PFO sono significativamente associati allo stroke nei pazienti giovani (età< 55 anni). L’evidenza che nei giovani l’ASA ed il PFO sono associati all’ischemia cerebrale non può più essere considerata accidentale. I tradizionali fattori di rischio sembrano avere un ruolo molto più importante negli adulti (età> 55 anni) e negli anziani, nei quali, invece, il ruolo dell’ASA e del PFO non è tutt’oggi, confermato.
Tuttavia dai dati risultanti dalla metanalisi di Overell va considerato quale possa essere il ruolo dell’ASA nelle ricorrenze di stroke e quale è il suo significato prognostico specie nei pazienti giovani già colpiti da stroke criptogenetico in modo da verificare la reale “pericolosità” come risk-factor di stroke focale e poter cosi effettuare prevenzione secondaria.

In uno studio multicentrico prospettico pubblicato nel 2001 da Mas JL et al sul N Engl J Med è stato calcolato il rischio relativo e assoluto di eventi stroke associati a PFo, ASA o entrambi nei giovani affetti da stroke criptogenetico. La correlazione è risultata del 15,2 % nei pazienti con ASA e PFO mentre non ci sono risultati per l’ASA isolato.
L’ASA isolato quindi non sembra essere potenzialmente emboligeno ma la sua causalità nel determinare stroke criptogenetico è associata ad altre anomalie quali PFO,DIA, Prolasso valvolare mitralico, Pervietà del dotto di Botallo, Aritmie sopraventricolari.
L’associazione più frequentemente riscontrata è ASA + PFO, la stretta relazione tra le due anomalie ha fatto sì che il meccanismo dell’embolia paradossa via PFO fosse considerato per lungo tempo il meccanismo attraverso il quale l’ASA determini lo stroke, tuttavia la diagnosi di ASA+PFO non è la prova assoluta che si sia verificato un fenomeno di embolia paradossa.
In questo caso sono necessari ulteriori riscontri come la presenza di materiale trombotico per una diagnosi di certezza o trombi nel circolo venoso per una diagnosi di presunzione.
Pertanto se si considera l’embolia paradossa come meccanismo patogenetico l’ASA isolato non può essere considerato embolico ma solo fattore di rischio associato che aumenterebbe la probabilità di shunt dx-sx favorendo, data la mobilità, il passaggio di piccoli trombi.
Altre anomalie associate all’ASA sono: Prolasso della mitrale, Presenza di residui embrionali.
Nel caso di associazione di ASA e prolasso della mitrale è stato ipotizzato un deficit del connettivo, tuttavia poiché nei pazienti con stroke la prevalenza del prolasso mitralico presenta una variabilità tra il 2 e il 40% il suo ruolo come fattore determinante è ancora controverso.
Per quanto riguarda l’associazione di ASA e valvola di Eustachio (residuo embrionale presente nella regione di sbocco della vena cava inferiore in atrio destro), sembrerebbe che la valvola di Eustachio determini embolia paradossa direzionando il flusso ematico verso la fossa ovale costituendo quindi fattore di rischio di stroke in caso di presenza di PFO.
A tal conclusione ci ha portato lo studio PICSS (Patient Foramen Ovale in Cryptogenetic Stroke Studi).
Successivamente nel 2004 Schuchlenzsul pubblicava su J Am. Soc. Echocardiog che vi era una maggiore predisposizione all’embolia paradossa nei pazienti con ASA e/o PFO e persistenza della valvola di Eustachio rispetto ai pazienti che non presentavano questo residuo embrionale.
Da quanto qui esposto, malgrado gli studi eseguiti, esistono tante perplessità nel ruolo dell’ASA, come protagonista unico o associato, nella patogenesi dell’embolia paradossa e quindi essere causa di stroke, pertanto si sono cercate altre ipotesi etiopatogenetiche per spiegare il ruolo dell’ASA nel determinismo stroke.
IPOTESI ARITMICA: la presenza di anomalie del setto favorirebbe la vulnerabilità atriale a causa di alterazioni del substrato elettrofisiologico. E’ stato infatti dimostrato precedentemente che, nei cuori di neonati con aritmie atriali vi era una prevalenza del 64% di ASA rispetto al 26 % dei cuori ritmici. Questi dati ci riportano alla vecchia ipotesi, formulata nell’ 85 da Hanley, secondo la quale l’ASA molto mobile è più facilmente associato nell’adulto a fibrillazione atriale, pertanto questi pazienti presentano un maggiore rischio embolico legato a crisi parossistiche di F.A.
FORMAZIONE DI TROMBI IN LOCO: tale evento è ipotizzabile negli ASA fissi, in quanto favorirebbero fenomeni di stasi ematica facilitando la formazione di trombi. Tale fenomeno tuttavia è poco descritto per la difficoltà di visualizzare o sospettare i trombi, anche se esistono dei reperti autoptici.
SEPTUM CRIBROSO: anatomicamente il setto può presentare una superficie cribrosa e in questo caso il rischio embolico sarebbe rappresentato da plurime perdite di sostanza di minime dimensioni, anche in questo caso vi sono descrizioni di singoli casi clinici o reperti autoptici.
ALTERAZIONI PROTROMBOTICHE GENETICHE: Alcuni studi hanno rilevato che difetti congeniti del plasminogeno e di alcuni fattori della coagulazione (Antitrombina III, Proteina C, Proteina S, Mutazioni del gene G1691a del fattore V, la variante protrombinica G20210A ), gli autoanticorpi antifosfolipidi circolanti sembrano favorire la trombogenicità delle anomalie del setto.
Tale evenienza è stata evidenziata nei bambini che presentano eventi ischemici cerebrali, tuttavia anche in questo caso, in letteratura esistono solo casi clinici isolati.
EMICRANIA: l’emicrania è stata a lungo considerata fattore di rischio di stroke, per la presenza di anomalie endoteliali, riduzione del flusso ematico cerebrale, iperaggregabilità piastrinica e per lungo tempo si è focalizzata l’attenzione sulla sua associazione con PFO e ASA.
Tuttavia tale relazione come si evince dalle ultime linee guida SPREAD è stata completamente ribaltata e riveduta.
Altre anomalie associate all’ASA sono: Prolasso della mitrale, Presenza di residui embrionali.
Nel caso di associazione di ASA e prolasso della mitrale è stato ipotizzato un deficit del connettivo, tuttavia poiché nei pazienti con stroke la prevalenza del prolasso mitralico presenta una variabilità tra il 2 e il 40% il suo ruolo come fattore determinante è ancora controverso.
Per quanto riguarda l’associazione di ASA e valvola di Eustachio (residuo embrionale presente nella regione di sbocco della vena cava inferiore in atrio destro), sembrerebbe che la valvola di Eustachio determini embolia paradossa direzionando il flusso ematico verso la fossa ovale costituendo quindi fattore di rischio di stroke in caso di presenza di PFO.
A tal conclusione ci ha portato lo studio PICSS (Patient Foramen Ovale in Cryptogenetic Stroke Studi).
Successivamente nel 2004 Schuchlenzsul pubblicava su J Am. Soc. Echocardiog che vi era una maggiore predisposizione all’embolia paradossa nei pazienti con ASA e/o PFO e persistenza della valvola di Eustachio rispetto ai pazienti che non presentavano questo residuo embrionale.
Da quanto qui esposto, malgrado gli studi eseguiti, esistono tante perplessità nel ruolo dell’ASA, come protagonista unico o associato, nella patogenesi dell’embolia paradossa e quindi essere causa di stroke, pertanto si sono cercate altre ipotesi etiopatogenetiche per spiegare il ruolo dell’ASA nel determinismo stroke.
Attualmente le conoscenze a disposizione non consentono di affermare che le anomalie del setto interatriale, da sole, possano determinare la formazione di emboli e quindi la comparsa di ictus.
Infatti sono molto più frequenti le associazioni tra ASA, oltre che al PFO, con varie anomalie atriali (difetti interatriali, aritmie atriali, prolasso valvolare mitralico,etc.) sopratutto nei soggetti con età inferiore ai 55 anni.
Ciascuna di queste anomalie potrebbe essere una potenziale fonte di emboli. Quindi non è affatto facile determinare quanto l’ASA isolato possa essere una sorgente indipendente di emboli.
Anche quando sono stati ipotizzati altri meccanismi patogenetici (ASA cribroso, associazione ASA-fibrillazione atriale, trombi nella sacca aneurismatica, embolia paradossa tramite PFO, fattori genetici incidenti sulla coagulazione) non è stato possibile dimostrare appieno queste ipotesi.
Pertanto sono necessari numerosi ulteriori studi per poter confermare se l’ASA (isolato e non), sia una causa diretta di ischemie cerebrali o una concausa o soltanto un ulteriore fattore di rischio.
Conclusioni
Attualmente le conoscenze a disposizione non consentono di affermare che le anomalie del setto interatriale, da sole, possano determinare la formazione di emboli e quindi la comparsa di ictus.
Infatti sono molto più frequenti le associazioni tra ASA, oltre che al PFO, con varie anomalie atriali (difetti interatriali, aritmie atriali, prolasso valvolare mitralico,etc.) sopratutto nei soggetti con età inferiore ai 55 anni.
Ciascuna di queste anomalie potrebbe essere una potenziale fonte di emboli. Quindi non è affatto facile determinare quanto l’ASA isolato possa essere una sorgente indipendente di emboli.
Anche quando sono stati ipotizzati altri meccanismi patogenetici (ASA cribroso, associazione ASA-fibrillazione atriale, trombi nella sacca aneurismatica, embolia paradossa tramite PFO, fattori genetici incidenti sulla coagulazione) non è stato possibile dimostrare appieno queste ipotesi.
Pertanto sono necessari numerosi ulteriori studi per poter confermare se l’ASA (isolato e non), sia una causa diretta di ischemie cerebrali o una concausa o soltanto un ulteriore fattore di rischio.
