Hypertrophic cardiomyopathy, Heart disease, Vector image
La maggioranza dei casi di cardiomiopatia ipertrofica è causata da un difetto genetico ereditario.
I pazienti manifestano svenimento, dolore toracico, respiro affannoso e palpitazione (percezione di battiti cardiaci irregolari).
Il sospetto della diagnosi si basa sui riscontri dell’esame obiettivo, ma la conferma giunge attraverso l’impiego di ecocardiogramma o risonanza magnetica per immagini.
La terapia prevede la somministrazione di farmaci che riducono la forza delle contrazioni cardiache.
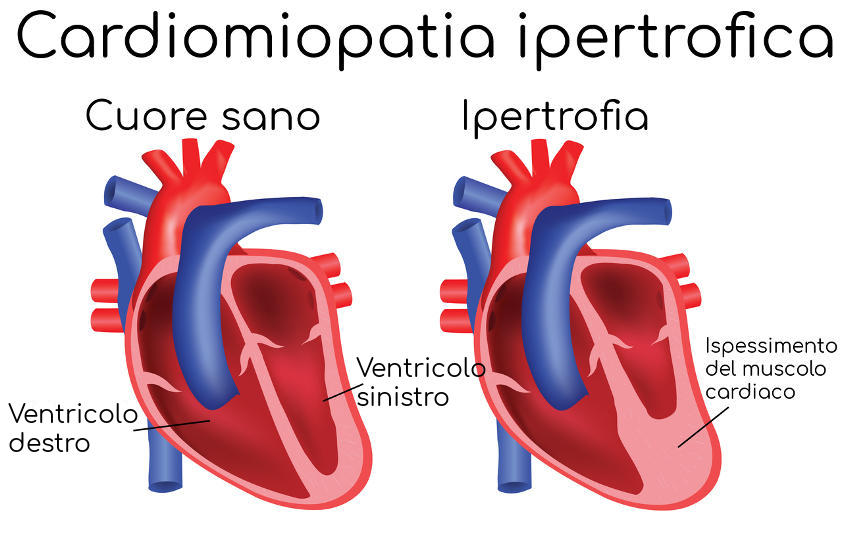
Il termine cardiomiopatia è usato solo quando un disturbo colpisce direttamente il muscolo cardiaco. Altri disturbi, come l’ipertensione e anormalità delle valvole cardiache (come la stenosi aortica), possono anch’essi alla fine provocare un ispessimento del muscolo cardiaco e insufficienza cardiaca. Tuttavia, i medici non classificano i problemi del muscolo cardiaco causati da questi disturbi come cardiomiopatie.
La cardiomiopatia ipertrofica è una causa comune di morte improvvisa nei giovani atleti. È colpita almeno 1 persona su 500.
Cause
La cardiomiopatia ipertrofica congenita è provocata quasi sempre da
Una mutazione genetica spontanea o un difetto genetico ereditario

Molto raramente, la cardiomiopatia ipertrofica viene acquisita in presenza di malattie come acromegalia (crescita eccessiva dovuta a una sovrapproduzione di ormone della crescita, generalmente per la presenza di un tumore ipofisario benigno), feocromocitoma (tumore che produce una quantità eccessiva dell’ormone epinefrina) o neurofibromatosi (una malattia genetica in cui nella regione sottocutanea e in altre parti del corpo proliferano escrescenze di consistenza molle e carnosa di tessuto nervoso).
Complicanze
Le pareti spesse e rigide dei ventricoli non si rilassano in maniera adeguata per consentire il riempimento di sangue delle camere cardiache. La difficoltà aumenta quando il cuore batte rapidamente (come quando sotto sforzo), perché, in tali condizioni, il tempo per riempirsi è ancora meno. Poiché il cuore non si riempie correttamente, pompa una quantità di sangue inferiore ad ogni battito. A volte un ispessimento delle pareti cardiache interferisce anche con la fuoriuscita del sangue dal cuore. Questa variazione prende il nome di cardiomiopatia ostruttiva ipertrofica.
A causa dell’ispessimento delle pareti dei ventricoli, la valvola mitrale (valvola che si apre dall’atrio sinistro all’interno del ventricolo sinistro) può non essere in grado di chiudersi normalmente, determinando così il reflusso di una piccola quantità di sangue nell’atrio sinistro (rigurgito mitralico). Questa perdita valvolare e l’ingrossamento delle pareti ventricolari causa generalmente un’alterazione dei toni cardiaci (soffi cardiaci).
Possono insorgere aritmie, che possono provocare morte improvvisa.
Sintomi
I sintomi sono altamente variabili, ma, quando insorgono, si sviluppano generalmente nei soggetti di età compresa fra 20 e 40 anni. I sintomi si osservano inizialmente sotto sforzo e includono
Svenimento (sincope)
Dolore toracico
Respiro affannoso
Percezione di battito cardiaco irregolare (palpitazioni)
Lo svenimento ha generalmente luogo all’improvviso senza sintomi d’allarme. Lo svenimento può essere il primo segno della presenza di questa patologia. In alcuni casi, il soggetto può anche essere colto da morte improvvisa.
Diagnosi
Ecocardiografia e/o RMI
Il sospetto della diagnosi di cardiomiopatia ipertrofica si basa sulla sintomatologia, sugli esiti dell’esame obiettivo, dell’elettrocardiogramma (ECG) e di una radiografia toracica. I toni cardiaci e soffi rilevati dallo stetoscopio possono essere utili indizi.
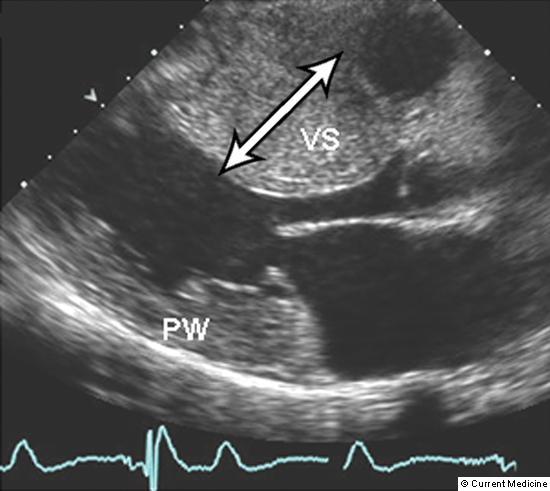
L’ecocardiografia è il metodo migliore per confermare la diagnosi, ma può trovare impiego anche la RMI, perché offre informazioni più dettagliate.
Il cateterismo cardiaco, una procedura invasiva nella quale un catetere viene introdotto nel cuore attraverso un vaso del braccio o della gamba, viene utilizzato per misurare la pressione nelle camere cardiache se si sta valutando un approccio chirurgico.
Poiché la cardiomiopatia ipertrofica è generalmente causata da una mutazione genica, occorrono anche le analisi genetiche.
Prognosi
Ogni anno, circa l’1% dei soggetti adulti affetti da cardiomiopatia ipertrofica muore. La popolazione pediatrica con cardiomiopatia ipertrofica è più soggetta al rischio di decesso degli adulti.
Altri fattori che suggeriscono un maggior rischio di decesso includono i seguenti:
Anamnesi familiare di morte improvvisa
Svenimento inspiegato
Presenza di ritmo cardiaco rapido e anomalo
Risposta pressoria anomala sotto sforzo
Gravità dell’ispessimento del muscolo cardiaco
Aspetto caratteristico alla RMI
Solitamente la morte è improvvisa e verosimilmente dovuta ad aritmia. La morte dovuta a insufficienza cardiaca cronica è meno frequente.
I soggetti che sanno di avere ereditato la patologia possono richiedere una visita genetica, se sono intenzionati a formare una famiglia, infatti hanno il 50% di probabilità di trasmettere la malattia ai figli. I familiari di soggetti affetti da questa patologia ereditaria possono valutare l’ipotesi di sottoporsi ad analisi genetiche.
Trattamento
Farmaci come un beta-bloccante e/o un bloccante dei canali di calcio
Talvolta un intervento per migliorare il flusso ematico
Talvolta un defibrillatore-cardioversore impiantabile
Se possibile, il medico tratta la condizione alla base della cardiomiopatia ipertrofica.
Il trattamento della cardiomiopatia ipertrofica è mirato soprattutto a ridurre la resistenza opposta dal cuore al ritorno del sangue tra un battito e l’altro.
Farmaci per la cardiomiopatia ipertrofica
I beta-bloccanti e il calcio-antagonista verapamil, da soli o in associazione ad altri farmaci, costituiscono il trattamento principale. Entrambi riducono la forza delle contrazioni del muscolo cardiaco. Di conseguenza, il cuore può riempirsi meglio e, inoltre, se il muscolo ispessito stava ostruendo il flusso sanguigno, il sangue potrà ora essere espulso dal cuore con più facilità. I beta-bloccanti e il verapamil rallentano la frequenza cardiaca, lasciando più tempo al cuore per riempirsi. A volte viene utilizzato anche il disopiramide, un farmaco che riduce la forza di contrazione del cuore.
L’amiodarone è talvolta utilizzato per trattare le aritmie.
Miectomia
Un intervento chirurgico volto all’asportazione di una porzione del muscolo cardiaco ispessito (miectomia) può migliorare il flusso sanguigno proveniente dal cuore, ma viene eseguito solo quando i sintomi hanno un carattere invalidante nonostante il trattamento farmacologico. L’intervento può alleviare i sintomi, ma non riduce il rischio di morte. Tuttavia, quando la miectomia è eseguita in strutture ospedaliere che hanno vasta esperienza nell’esecuzione di questi interventi, i risultati a lungo termine sono eccellenti.
Ablazione alcolica
L’ablazione alcolica (distruzione controllata di una piccola porzione del muscolo cardiaco mediante l’iniezione di alcol) è sempre più diffusa in certi soggetti al fine di migliorare il flusso ematico dal cuore, perché può essere effettuata durante il cateterismo cardiaco. Anche se quest’ultima procedura è invasiva, in quanto si inserisce un catetere nel cuore, è associata a rischi inferiori rispetto all’intervento chirurgico.
Defibrillatore-cardioversore impiantabile
I soggetti con grave ispessimento del muscolo cardiaco, specialmente l’ispessimento della parete che separa le camere cardiache (setto cardiaco), presentano un alto rischio di morte improvvisa. In questi individui i medici possono raccomandare un defibrillatore-cardioconversore impiantabile.
